
















Հալոգեններ՝ պարզ նյութեր:
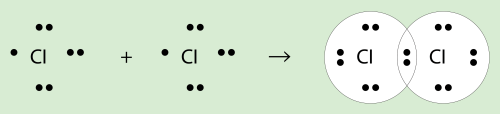
Քլորի մոլեկուլի առաջացումը
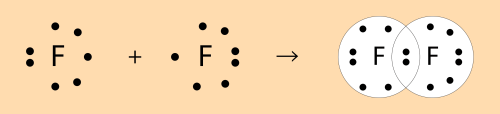
Ֆտորի մոլեկուլի առաջացումը
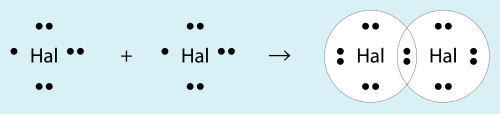
Հալոգենների մոլեկուլի առաջացումը
Ուշադրություն
Բոլոր ագրեգատային վիճակներում (գազային, գոլորշի, հեղուկ կամ պինդ) հալոգեն պարզ նյութերը կազմված են երկատոմ մոլեկուլներից
Ֆտորը` սուր գրգռող հոտով, բաց դեղին գույնի գազ է \((\)\(20°C\)\()\), չի հեղուկանում:

Ֆտոր՝ \((\)\()\)
Քլորը՝ սուր խեղդող հոտով, դեղնականաչ գույնի գազ է \((20°C)\), ճնշման տակ հեղուկանում է:

Քլոր՝
Բրոմը՝ տհաճ հոտով, կարմրագորշ \((20°C)\) հեշտ ցնդող հեղուկ է:

Բրոմ՝
Յոդը՝ սուր հոտով, մուգ մանուշակագույն՝ մետաղական փայլով, \(20°C\)-ում պինդ նյութ է, որը հեշտ ենթարկվում է սուբլիմացման (պինդ վիճակից ամիջապես անցնումը գազային վիճակի):

Յոդ՝
Մոլային զանգվածի մեծացման հետ հալոգենների հալման և եռման ջերմաստիճանները բարձրանում են, մեծանում է խտությունը, ինչը պայմանավորված է միջմոլեկուլային փոխազդեցության ուժերի մեծացման հետ:
Քլորը, բրոմը և յոդը ջրում վատ են լուծվում, ֆտորը փոխազդում է ջրի հետ:
Հալոգեններն ազատ վիճակում շատ թունավոր են, նույնիսկ յոդը, եթե նրա կոնցենտրացիան օդում մեծ է:
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015