
















Ֆոսֆորի քիմիական հատկությունները

Ֆոսֆորը միացություններում \(-3\)-ից \(+5\) օքսիդացման աստիճաններ է դրսևորում, սակայն այդ տարրին առավել բնորոշ են \(-3\), \(+3\), \(+5\) օքսիդացման աստիճանները՝ օժտված օքսիդավերականգնման երկակիությամբ:
Իրենից ավելի փոքր էլեկտրաբացասականություն ունեցող տարրերի, օրինակ՝ մետաղների հետ փոխազդելիս այն օքսիդիչ է՝
Իրենից ավելի փոքր էլեկտրաբացասականություն ունեցող տարրերի, օրինակ՝ մետաղների հետ փոխազդելիս այն օքսիդիչ է՝
Այդ փոխազդեցության արդյունքում առաջանում են ֆոսֆիդներ։ Օրինակ, բարձր ջերմաստիճաններում ֆոսֆորը միանում է մագնեզիումին՝ առաջացնելով մագնեզիումի ֆոսֆիդ․
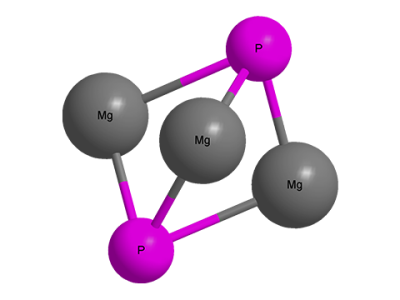
Մագնեզիումի ֆոսֆիդի մոլեկուլի մոդելը
Ֆոսֆորը ջրածնի հետ անմիջականորեն չի միանում: Ջրածնային միացությունը՝ (ֆոսֆորաջրածին կամ ֆոսֆին), կարելի է ստանալ ֆոսֆիդների ու ջրի կամ թթվի փոխազդեցությունից․
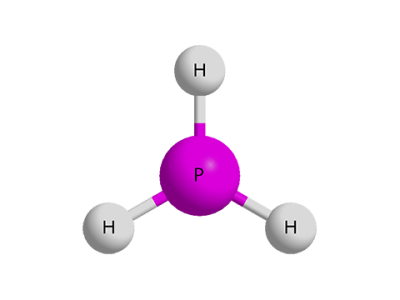
Ֆոսֆինի մոլեկուլի մոդելը
Ֆոսֆինը տհաճ (նեխած ձկան) հոտով, խիստ թունավոր, անկայուն գազ է, ջրում գործնականորեն չի լուծվում, իսկ օդում ինքնաբերաբար բռնկվում է՝ ֆոսֆորի\((V)\) օքսիդ ու ջուր առաջացնելով, որոնց փոխազդեցությունից ստացվում է ֆոսֆորական թթու․
Ֆոսֆինը տհաճ (նեխած ձկան) հոտով, խիստ թունավոր, անկայուն գազ է, ջրում գործնականորեն չի լուծվում, իսկ օդում ինքնաբերաբար բռնկվում է՝ ֆոսֆորի\((V)\) օքսիդ ու ջուր առաջացնելով, որոնց փոխազդեցությունից ստացվում է ֆոսֆորական թթու․

Ֆոսֆինի այրումը
Իրենից ավելի մեծ էլեկտրաբացասականություն ունեցող ոչ մետաղների, օրինակ` քլորի, թթվածնի հետ, ֆոսֆորը ցուցաբերում է վերականգնող հատկություն՝
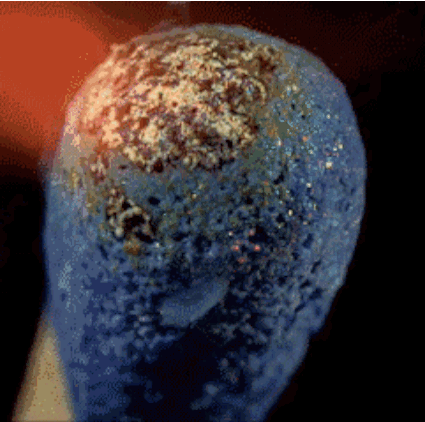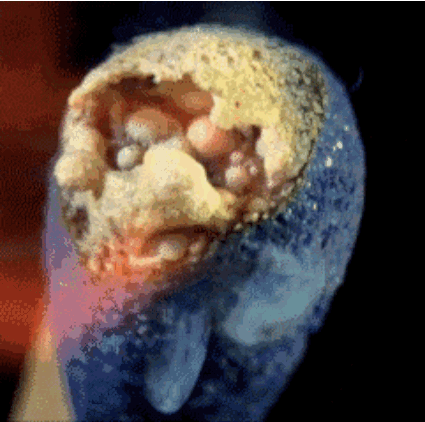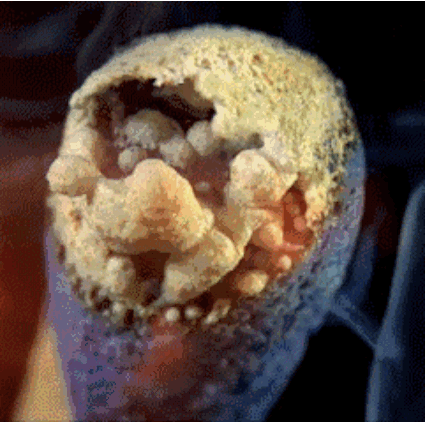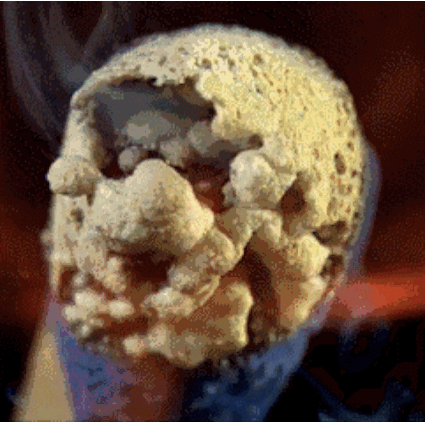
Թթվածնում ֆոսֆորն այրվում է շլացուցիչ, սպիտակ բոցով՝ առաջացնելով սպիտակ ծխի տեսքով ֆոսֆորի\( (V)\) օքսիդ.
Թթվածնում ֆոսֆորն այրվում է շլացուցիչ, սպիտակ բոցով՝ առաջացնելով սպիտակ ծխի տեսքով ֆոսֆորի\( (V)\) օքսիդ.

Ֆոսֆորի այրումը
Ֆոսֆորը միանում է քլորին ավելի եռանդուն, քան թթվածնին.

Կարմիր ֆոսֆորի ու կալիումի քլորատի՝ Բերթոլեի աղի \((\)\()\) խառնուրդը շփելիս (տրորելիս) կամ սեղմելիս բոցավառվում է պայթյունով (լուցկու ռեակցիա).
Բերթոլեի աղի և ծծմբի խառնուրդ պարունակում է լուցկու հատիկի գլխիկը, իսկ կարմիր ֆոսֆորով պատված է լուցկու տուփի կողերի մակերեսը:
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015