
















Ծծբի ատոմի կառուցվածքը և տարածվածությունը բնության մեջ:
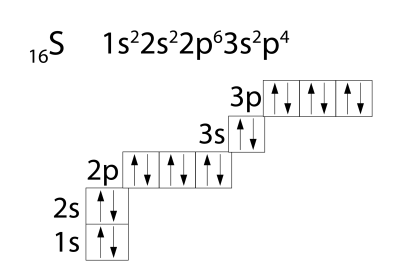
Ծծմբի ատոմները (հիմնական վիճակում) արտաքին էներգիական մակարդակում պարունակում են \(6\) էլեկտրոն, որոնցից երկուսը չզույգված են (կենտ են), ուստի ցուցաբերում է վալենտականություն \(2\)
Քիչ քանակությամբ էներգիա կլանելով՝ ծծմբի ատոմը կարող է անցնել գրգռված վիճակի, ինչը տեղի է ունենում ավելի մեծ էլեկտրաբացասականությամբ քիմիական տարրերի ատոմների հետ քիմիական կապ առաջացնելիս: Թափուր \(3d\)-օրբիտալների հաշվին ծծմբի ատոմի չզույգված էլեկտրոնների թիվը կարող է մեծանալ՝ \(4\) կամ \(6\) դառնալ, իսկ վալենտականությունը՝ համապատասխանաբար \(4\), \(6\)
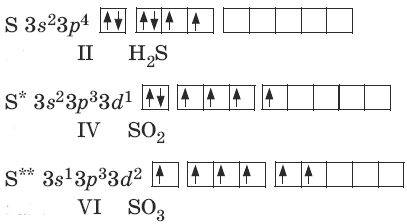
Թթվածնի ատոմների համեմատությամբ ծծմբի ատոմներն ունեն մեծ շառավիղ, էլեկտրաբացասականության փոքր արժեք, որի պատճառով էլ ցուցաբերում են արտահայտված վերականգնիչ հատկություն` առաջացնելով միացություններ, որոնցում ծծմբի ատոմները ցուցաբերում են \(+2\), \(+4\), \(+6\) օքսիդացման աստիճան: Ավելի փոքր էլեկտրաբացասականությամբ օժտված տարրերի հետ (ջրածին, մետաղներ) փոխազդելիս ծծումբը ցուցաբերում է օքսիդիչ հատկություն` ձեռք բերելով \(–2\)-ի հավասար օքսիդացման աստիճան:
Բնության մեջ ծծումբը հանդիպում է երեք ձևով:
1. Բնածին կամ ինքնածին ծծումբ, որը ծծմբի շեղանկյուն տարաձևությունն է ()

2. Սուլֆիդային ծծումբ` ծծմբաջրածինը և նրա աղերը. ցինկի խաբուսակ` \(ZnS\), կինովար` \(HgS\), կապարափայլ` \(PbS\), պիրիտ ( ծծմբահրաքար)` , երկաթի\((II)\) սուլֆիդ` \(FeS\) և այլն:


երկաթի\((II)\) սուլֆիդ` \(FeS\) պիրիտ`
3. Սուլֆատային ծծումբ՝ գլաուբերյան աղ` , գիպս` , պղնձարջասպ` , երկաթարջասպ` և այլն:


գլաուբերյան աղ` գիպս`


պղնձարջասպ` երկաթարջասպ`
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015