
















Ծծմբի\((IV)\) օքսիդ:
Ծծմբի\((IV)\) օքսիդ` (ծծմբային անհիդրիդ կամ ծծմբային գազ)
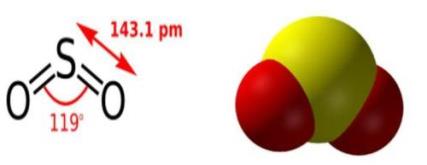
-ի կառուցվածքային բանաձևը և մոլեկուլի մոդելը
Ուշադրություն
-ի մոլեկուլում քիմիական կապը կովալենտային բևեռային է, ծծմբի օքսիդացման աստիճանը` \(+4\)
Ֆիզիկական հատկությունները:
Սուր հոտով, օդից \(2,2\) անգամ ծանր անգույն գազ է, լավ լուծվում է ջրում (\(1\) ծավալ ջրում լուծվում է \(40\) ծավալ (ն.պ.) )

Ստացումը արդյունաբերության մեջ:

Արդյունաբերության մեջ ստացվում է.
- Ծծումբը թթվածնում այրելիս.
- Սուլֆիդների օքսիդացումից.
- Ծծմբաջրածնի լրիվ այրումից.
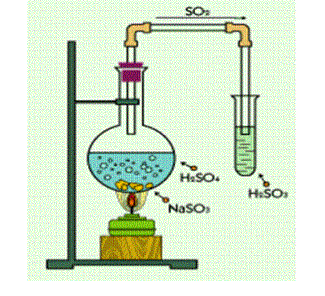
Ստացումը լաբորատորիայում:

Լաբորատորիայում ծծմբային գազ ստանում են չոր սուլֆիտների հետ ծծմբական թթվի խառնուրդի տաքացումից.
Քիմիական հատկությունները:
-ը թթվային օքսիդ է, ուստի ցուցաբերում է թթվային օքսիդներին բնորոշ հատկություններ: Այն փոխազդում է
- Ջրի հետ.
Ջրում լուծելիս առաջացնում է թույլ երկհիմն, անկայուն թթու` (գոյություն ունի միայն ջրային լուծույթում).

Ծծմբային թթվի ստացումը
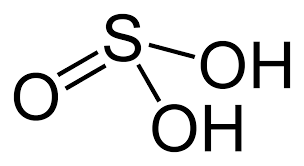
Ծծմբային թթվի մոլեկուլի կառուցվածքը
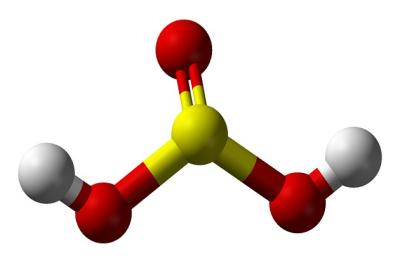
Ծծմբային թթվի մոլեկուլի մոդելը
- Ալկալիների հետ.
Ծծմբի\((IV)\) օքսիդը` և ալկալիների (լուծույթների) փոխազդեցության հետևանքով առաջանում են երկու տեսակի աղեր՝ թթու՝ հիդրոսուլֆիտներ և չեզոք՝ սուլֆիտներ


Նատրիումի հիդրոսուլֆիտ՝ Նատրիումի սուլֆիտ՝
- Հիմնային օքսիդների հետ.
Ծծմբի\((IV)\) օքսիդում ծծումբ տարրի օքսիդացման աստիճանը \(+4\) է և ռեակցիաներում կարող է ցուցաբերել և՛ օքսիդացնող, և՛ վերականգնող հատկություններ:
Օքսիդացման ռեակցիաներ՝
Վերականգնման ռեակցիայի օրինակ՝
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015