
















Ազոտի օքսիդները
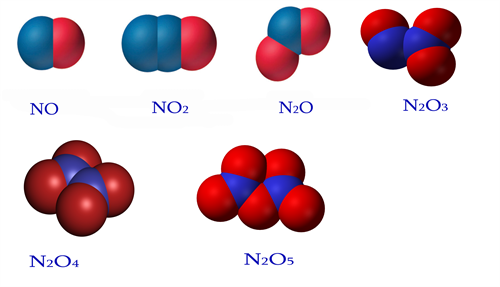
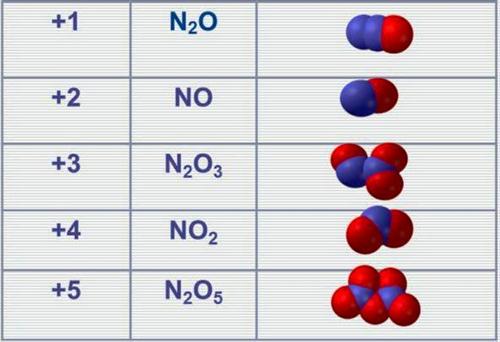
Ազոտն առաջացնում է օքսիդներ, որոնցում դրսևորում է \(+1-\)ից մինչև \(+5\) օքսիդացման աստիճաններ.
Ազոտի\((I)\) օքսիդ`
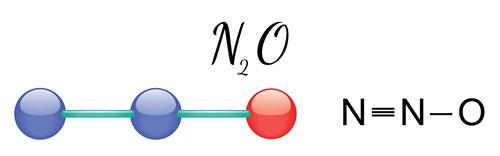
Ազոտի\((I)\) օքսիդը հաճելի հոտով, անզգայացնող հատկությամբ անգույն գազ է, որը այլ կերպ անվանում են ծիծաղաբեր գազ:
Ջրում չի լուծվում ու անտարբեր օքսիդների շարքին է դասվում։
Լաբորատորիայում ստանում են ամոնիումի նիտրատի ջերմային քայքայումից.
Ազոտի\((II)\) օքսիդ`
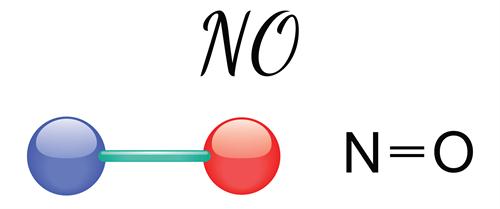
Անգույն, անհոտ, ջրում չլուծվող գազ է: \(NO\)-ն անտարբեր օքսիդ է և օդում արագ օքսիդանում է՝ առաջացնելով ազոտի \((IV)\) օքսիդ։ Առաջանում է օդում ամպրոպի ընթացքում․
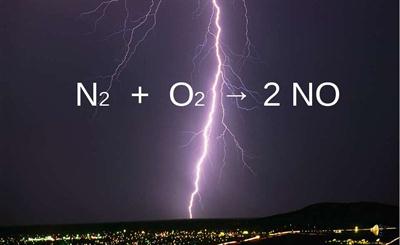
Արդյունաբերության մեջ ստացվում է ամոնիակի կատալիտիկ օքսիդացումից.
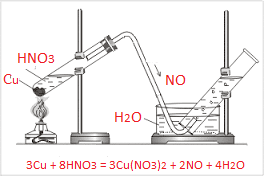
Լաբորատորիայում ստանում են պղնձի ու նոսր ազոտական թթվի փոխազդեցությունից`
Պարզ նյութերի՝ ազոտի ու թթվածնի անմիջական փոխազդեցությունից միայն ազոտի\((II)\) օքսիդ է ստացվում, իսկ ազոտի մյուս օքսիդներն ստացվում են անուղղակի ճանապարհով։
Ազոտի \((III)\) օքսիդ՝
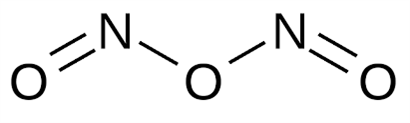
օքսիդը անկայուն միացություն է։ Գոյություն ունի \(-5°C\)-ից ցածր ջերմաստիճանում, կապույտ հեղուկ է: Այս օքսիդն ազոտային թթվի անհիդրիդն է:
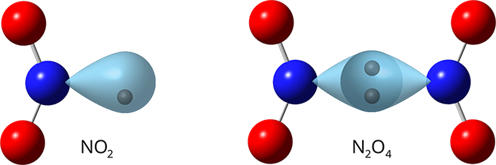
Ազոտի\((IV)\) օքսիդ՝
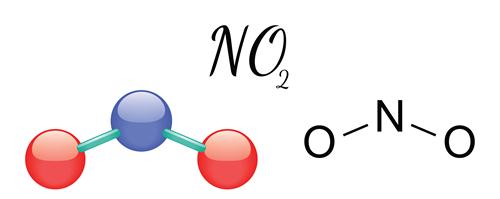
Հեղձուցիչ հոտով, գորշ դարչնագույն գազ է (այդ գազը հաճախ անվանում են «աղվեսի պոչ»)։ Սառեցնելիս վերածվում է գրեթե անգույն (բաց դեղին) հեղուկի, որի մոլեկուլի բաղադրությունը`
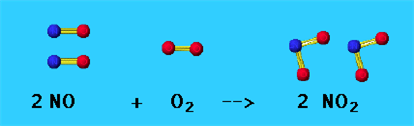
Սովորական պայմաններում ստացվում է հետևյալ փոխազդեցությունից՝
Ազոտի\((IV)\) օքսիդ կարելի է ստանալ որոշ մետաղների և խիտ ազոտական թթվի փոխազդեցությունից.
Օրինակ՝ պղնձի և խիտ ազոտական թթվի փոխազդեցությունից

Ազոտի\((IV)\) օքսիդն ազոտային թթվի և ազոտական թթվի խառն անհիդրիդն է։ Սառը ջրում այդ նյութը լուծելիս նշված երկու թթվի խառնուրդն է ստացվում.
Ազոտի\((V)\) օքսիդ՝
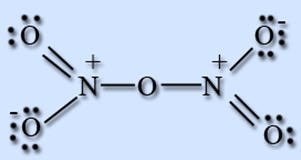
օքսիդը՝ ազոտական թթվի անհիդրիդն է, պինդ, անգույն նյութ է։ Այս օքսիդը կարելի է ստանալ օրինակ՝ հետևյալ կերպ.
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015