
















Ազոտական թթու
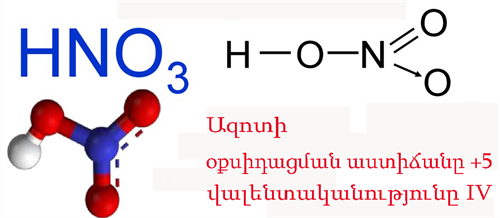
Ֆիզիկական հատկությունները
Ազոտական թթուն օդում ուժեղ «ծխում» է, քանի որ խոնավ օդում ջրային գոլորշիների հետ մասամբ հեղուկ թթվի մանր կաթիլներից բաղկացած քուլաներ են առաջանում։

Քիմիական հատկությունները
Ազոտական թթուն շատ ուժեղ միահիմն թթու է և ջրում գրեթե լրիվ դիսոցվում է:
Ազոտական թթուն, ինչպես և մյուս թթուները, փոխազդում է հիմքերի, հիմնային օքսիդների, աղերի (կարբոնատների, սուլֆիտների ու սիլիկատների) հետ:
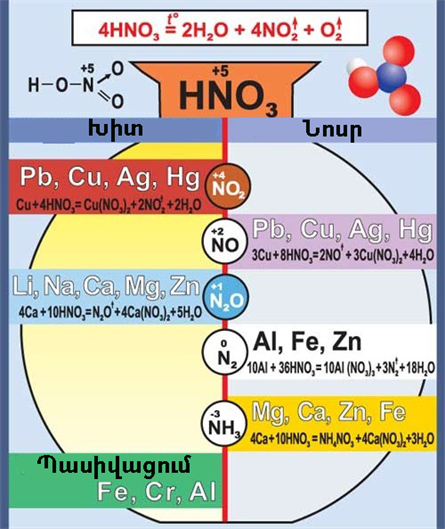
Ազոտական թթուն մետաղների հետ յուրահատուկ կերպով է փոխազդում, մյուս թթուների նման ջրածին չի անջատում, այլ անջատում է ազոտի օքսիդներ, ամոնիակ (ամոնիումի նիտրատ) կամ ազատ ազոտ։ Նշանակում է՝ այս դեպքում վերականգնվում է ոչ թե ջրածինը, այլ ազոտը, որի օքսիդացման աստիճանը \(+5\)-ից կարող է նվազել մինչև \(-3\)
Մետաղների հետ ազոտական թթվի փոխազդեցության այս կամ այն ձևը կախված է թթվի կոնցենտրացիայից ու փոխազդող մետաղի ակտիվությունից։
Ազոտական թթվի մոլեկուլի անկայունությունը կարևոր առանձնահատկություն է։ Ջրային լուծույթում այդ թթուն համեմատաբար ավելի կայուն է։ Մինչդեռ \(98\)% զանգվածային բաժնով ազոտական թթուն անկայուն միացություն է, լույսի ազդեցությամբ քայքայվում է:
Ստացումը
Բնության մեջ քիչ քանակությամբ ազոտական թթու առաջանում է ամպրոպների ընթացքում։ Էլեկտրական պարպումների ազդեցությամբ օդի հիմնական բաղադրամասերը՝ ազոտը և թթվածինը, փոխազդում են՝ առաջացնելով ազոտի\((II)\) օքսիդ:
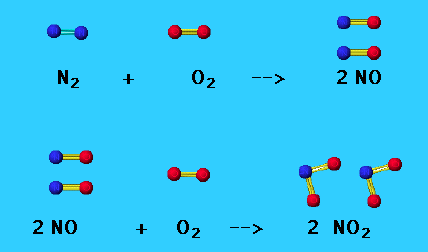
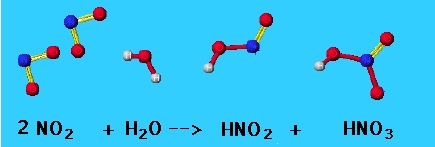
Արդյունաբերական եղանակով ազոտական թթու ստացվում է միմյանց հաջորդող չորս փուլերով:
Առաջին փուլ՝ ամոնիակի սինթեզ
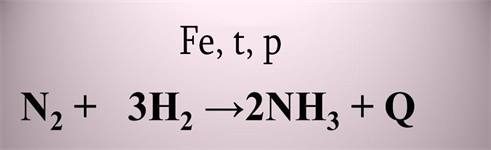
Երկրորդ փուլ՝ ամոնիակի կատալիտիկ օքսիդացում

Օքսիդացումն ընթանում է հպումային սյունակաթսայում՝ \(550–600°C\) ջերմաստիճանում, պլատին-ռոդիում համաձուլվածք \((Pt-Rh)\) կատալիզատորի ներկայությամբ։
Երրորդ փուլ՝ ազոտի\((II)\) օքսիդի օքսիդացումը համեմատաբար ցածր ջերմաստիճանում.

Չորրորդ փուլ՝ ջրում ազոտի\((IV)\) օքսիդի լուծում թթվածնի մասնակցությամբ.

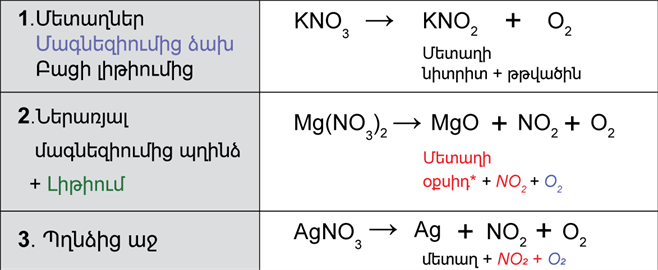
Ազոտական թթվի աղերը՝ նիտրատները
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015