
















Սիլիցիումի ստացումը և քիմիական հատկությունները
 \(\)
\(\)Սիլիցիումի ստացումը
Արդյունաբերության մեջ բյուրեղային սիլիցիում ստանում են բարձր ջերմաստիճաններում՝ սիլիցիումի \((IV)\) օքսիդի` , ու ածխի (կոքսի) փոխազդեցությունից:
Եթե ածխածինն ավելցուկով է վերցված, ապա ռեակցիայի հետևանքով ստացված սիլիցիումը խիստ աղտոտված է լինում սիլիցիումի կարբիդով (կարբորունդ՝ \(SiC\))
Սիլիցիումի \((IV)\) օքսիդը մագնեզիումով, ալյումինով և այլ ակտիվ մետաղներով վերականգնելիս ստացվում է ամորֆ սիլիցիում: Այս դեպքում սիլիցիումի հետ առաջանում է նաև մետաղի սիլիցիդ:
Մաքուր սիլիցիում ստանում են սիլիցիումի քառաքլորիդը ցինկի գոլորշիներով վերականգնելով:
Քիմիական հատկությունները
Սիլիցիումը փոխազդում է հալոգենների հետ (միայն ֆտորի հետ սենյակային ջերմաստիճանում, իսկ մյուսների հետ՝ տաքացման պայմաններում) առաջացնելով քառահալոգենիդներ:
Տաքացված սիլիցիումը (մանրացված) այրվում է թթվածնում առաջացնելով մեծ սիլիցիումի\((IV)\) օքսիդ: Նշված ռեակցիայի հետևանքով անջատվում է մեծ քանակությամբ ջերմություն:
Սիլիցիումի և մետաղների փոխազդեցությունից առաջանում են սիլիցիդներ: Օրինակ՝
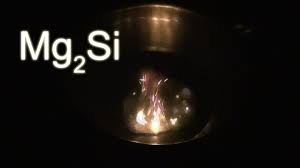
Սիլիցիումի ջրածնային միացությունը () անվանվում է սիլան, սակայն սիլիցիումը ջրածնի հետ չի փոխազդում և սիլան ստացվում է սիլիցիդների ու ջրի կամ թթվի փոխազդեցությունից:
Օրինակ
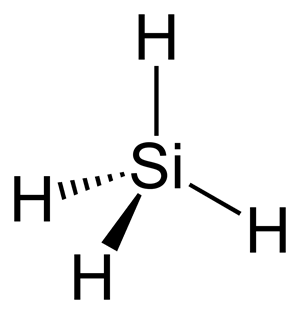
Սիլանի մոլեկուլի կառուցվածքը
Սիլանը թունավոր, անդուր (բորբոսի) հոտով, օդում ինքնաբոցավառվող գազ է:
Սիլիցիումը լուծվում է ալկալիների խիտ լուծույթներում՝ առաջացնելով սիլիկատներ և ջրածին:
Օրինակ
Սիլիցիումը չի լուծվում հանքային թթուներում, սակայն այն փոխազդում է \(1 : 3\) հարաբերությամբ վերցված ազոտական և ֆտորաջրածնական թթուների խառնուրդի հետ:
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015