
















Էլեկտրոլիտային դիսոցում
Հաղորդիչներ են այն նյութերը, որոնցում առկա են ազատ լիցքակիր մասնիկներ: Մետաղներում, որոնք համարվում են առաջին կարգի հաղորդիչներ, առկա են ազատ էլեկտրոններ, և էլեկտրական հոսանքը նրանցում էլեկտրոնների ուղղորդված հոսքն է.
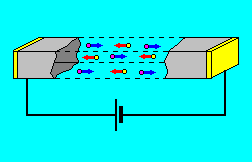
Որոշ նյութերի ջրային լուծույթներում (էլեկտրոլիտներում), որոնք համարվում են երկրորդ կարգի հաղորդիչներ, էլեկտրական հոսանքը իոնների հոսք է, այսինքն՝ էլեկտրոլիտներին բնորոշ է իոնային հաղորդականությունը.

Մ. Ֆարադեյ
Էլեկտրոլիտներ են այն նյութերը, որոնց ջրային լուծույթները էլեկտրական հոսանք են հաղորդում, իսկ ոչ էլեկտրոլիտներ են այն նյութերը, որոնց ջրային լուծույթները էլեկտրական հոսանք չեն հաղորդում:
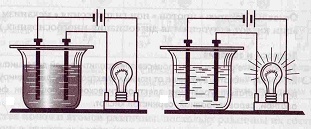
Նյութի պատկանելիությունը էլեկտրոլիտներին կարելի է ստուգել էլեկտրահաղորդականություն ստուգող սարքի միջոցով: Ինչպես երևում է նկարում, ոչ էլեկտրոլիտները հոսանք չեն անցկացնում, ինչի պատճառով լամպը չի վառվում, իսկ էլեկտրոլիտներում՝ վառվում է:
Աղերը, թթուները, հիմքերը էլեկտրոլիտ են, իսկ օրգանական միացությունների մեծ մասը (գլյուկոզ, սպիրտ, շաքար, ացետոն և այլն), ինչպես նաև մի շարք անօգանական նյութեր (թթվածին՝ , ազոտ՝ , ազոտի\((I)\) օքսիդ՝ և այլն) էլեկտրոլիտ չեն:
Հալված վիճակում հոսանքի հաղորդիչներ են նաև իոնական կապով բազմաթիվ միացություններ. աղեր, հիմքեր և որոշ օքսիդներ:
Գազային վիճակում գտնվող որոշ նյութերի (քլորաջրածին, բրոմաջրածին, ծծմբաջրածին և այլն) ջրային լուծույթները նույնպես էլեկտրական հոսանքի հաղորդիչներ են:
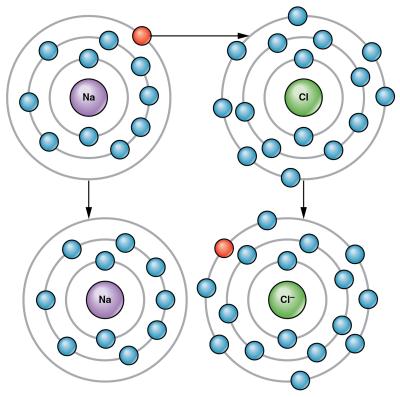
Իսկ ինչպե՞ս են ստեղծվում լիցքակիր մասնիկները՝ իոնները էլեկտրոլիտների լուծույթներում և հալույթներում: Առաջինն այս հարցին պատասխանել է շվեդ գիտնական Սվանտե Արենիուսը, ձևակերպելով էլեկտրոլիտային դիսոցման տեսության հիմնական դրույթները:

Ս. Ա. ԱՐԵՆԻՈւՍ
* Էլեկտրոլիտները հալչելիս կամ ջրում լուծվելիս տրոհվում են իոնների. ենթարկվում են էլեկտրոլիտային դիսոցման.հալույթում տեղի է ունենում ջերմային դիսոցում.
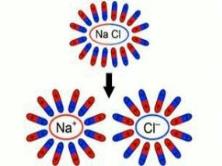
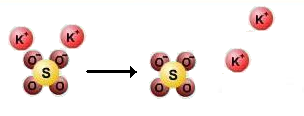
*Ջրային լուծույթներում իոնները քիմիապես կապված են ջրի մոլեկուլների հետ. հիդրատացված են, ինչի շնորհիվ տեղի է ունենում էլեկտրոլիտային դիսոցում.
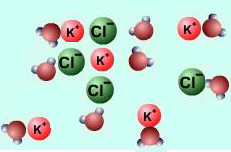
Սակայն դիսոցման հավասարումներ գրելիս իոնները հիդրատացված ձևով չեն ներկայացնում, այլ գրվում են պարզ ձևով.
օրինակ՝
Նկատենք, դիսոցման հետևանքով ստացված իոնների թիվը (քանակը) միշտ ավելի մեծ է սկզբնական մոլեկուլների թվից (քանակից):
*Իոններն ատոմներից տարբերվում են ինչպես էլեկտրոնային կառուցվածքով, այնպես էլ հատկություններով:
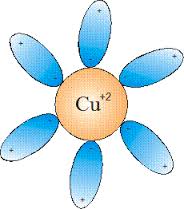
*Էլեկտրոլիտային դիսոցման գործընթացը դարձելի է. դիսոցման հետ միաժամանակ տեղի է ունենում ասոցում՝ իոններից մոլեկուլների առաջացում:
Օրինակ՝

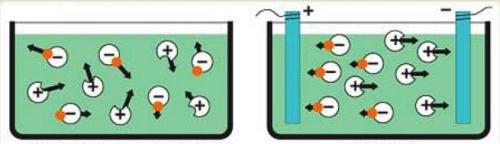
*Էլեկտրոլիտի լուծույթի կամ հալույթի միջով հաստատուն էլեկտրական հոսանք անցկացնելիս իոնների անկանոն շարժումը կարգավորվում է. դրական լիցքավորված իոնները՝ կատիոնները շարժվում են դեպի կաթոդ, իսկ բացասական լիցքավորված իոնները՝ անիոնները՝ դեպի անոդ:
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015