
















Քալկոգենների ընդհանուր բնութագիրը:
Թթվածին Ծծումբ Սելեն



Տելուր Պոլոնիում


\(VIA\) խմբի առաջին չորս անդամը` թթվածինը (հատկություններին դուք ծանոթ եք \(8\)-րդ դասարանի դասընթացից), ծծումբը, սելենը և տելուրը ոչ մետաղներ են, որոնց անվանում են քալկոգեններ (հանքածին):
Քալկոգենները բնության մեջ հանդիպում են մետաղների հետ առաջացրած միացությունների ձևով:
Օրինակ
Ծծմբի միացություններ` (սուլֆիդներ) երկաթի երկսուլֆիդ` , կապարի\((II)\) սուլֆիդ` \(PbS\), ցինկի սուլֆիդ՝ \(ZnS\) և այլն:



Պիրիտ՝ Կապարափայլ՝ \(PbS \) Ցինկի խաբուսակ՝ \(ZnS\)
Սելենը և տելուրի միացություններ՝ սելենիդներ և տելուրիդներ:

![Coloradoite_thumb[5].jpg](https://resources.cdn.imdproc.am/31524054-245d-4e96-ac0a-66eb457680a1/Coloradoite_thumb%5B5%5D.jpg)
Ցինկի սելենիդ՝ \(ZnSe \) Սնդիկի տելուրիդ՝ \(HgTe\)
Ուշադրություն
Պոլոնիումը ռադիոակտիվ է և բնության մեջ չի հանդիպում:
Քալկոգենների ատոմների արտաքին էլեկտրոնային շերտում գտնվում է \(6\) էլեկտրոն:
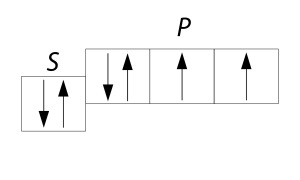
Քալկոգենների առավելագույն վալենտականությունը միացություններում համընկնում է խմբի համարին և հավասար է վեցի, բացառությամբ թթվածնի, որը որպես կանոն երկվալենտ է:
\(VIA\) խմբի տարրերի որոշ բնութագրիչները
| Քիմիական տարր | Էլեկտրաբացասականությունն ըստ Պոլինգի ցուցնակի | Ատոմի շառավիղ, նմ | Տարածվածությունը Երկրի կեղևում, զանգված. բաժին,% | Կարևոր օքսիդացման աստիճանները |
| \(O\) \((Z = 8)\) | \(3,5\) | \(0,066\) | \(47\) | \(–2\) |
| \(S (Z = 16\)\()\) | \(2,6\) | \(0,104\) | \(0,05\) | \(–2, +4, +6\) |
| \(Se (Z = 34)\) | \( \) \(2,5\) \( \) | \(0,160\) | \(5 · 10-6\) | \(–2, +4, +6\) |
| \(Te (Z = 52\)\()\) | \(2,1\) | \(0,17\) | \(1 · 10-7\) | \(–2, +4, +6\) |
| \(Po (Z=84)\) | \(2,0\) | տվյալներ չկան | - | \(–2, +2, +4, +6\) |
Պարբերության համարի մեծացման հետ ավելանում է \(VIA\) խմբի տարրերի ատոմների էլեկտրոնային շերտերի թիվը, և հետևաբար մեծանում են այդ խմբի տարրերի ատոմների շառավիղները, որի հետևանքով ոչ մետաղական հատկությունները թուլանում են, մետաղական հատկությունները` ուժեղանում:
Քալկոգենների ատոմների էլեկտրոմային բանաձևերը՝

Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015