
















Ամոնիակի քիմիական հատկությունները: Ամոնիումի աղերը
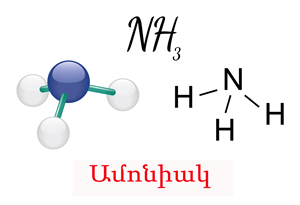
Ամոնիակն օժտված է հիմնային հատկություններով՝ ամոնիակի մոլեկուլում ազոտ տարրի չընդհանրացված էլեկտրոնային զույգի հաշվին։ Քանի որ ամոնիակի մոլեկուլում ազոտի ատոմի օքսիդացման աստիճանը նվազագույնն է` \( (-3)\), ուստի այդ ատոմն օժտված է վերականգնող հատկությամբ:
Ամոնիակի ու ջրի փոխազդեցությունը
Լուծվելիս ամոնիակը միանում է ջրի հետ՝ ամոնիումի հիդրօքսիդ առաջացնելով (ամոնիակաջուր), որը թույլ հիմք է (ֆենոլֆտալեինը մորեգույն է ներկվում):


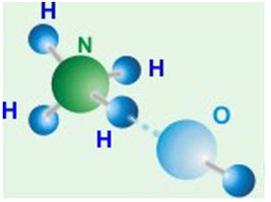
Ամոնիումի հիդրօքսիդի \((\)\()\)
մոլեկուլի մոդելը
Ամոնիակի և թթվածնի փոխազդեցությունը
Ամոնիակն օդում չի այրվում, բայց կարող է այրվել մաքուր թթվածնում՝

Թթվածնի ու ամոնիակի խառնուրդի մեջ պլատինե տաք պարույր տեղադրելիս (կատալիտիկ օքսիդացում) վերջինիս մակերեսին ամոնիակը փոխազդում է թթվածնի հետ՝ ազոտի\((II)\) օքսիդ և ջուր առաջացնելով: Ռեակցիայի հետևանքով անջատված ջերմության հաշվին պարույրը շիկանում է ու պայծառ լույս արձակում։

Ամոնիակի և որոշ մետաղների օքսիդների փոխազդեցությունը
Ամոնիակը որոշ մետաղների օքսիդների հետ տաքացնելիս վերականգնում է մետաղները:
Օրինակ՝
Ամոնիակի և թթուների փոխազդեցությունը
Ամոնիակը փոխազդում է թթուների հետ (և՛ անջուր, և՛ ջրային)՝ ամոնիումային աղեր առաջացնելով:
Օրինակ՝

(ամոնիումի քլորիդ)
Ամոնիումի աղերը
Ամոնիումի աղերը բյուրեղային միացություններ են՝ իոնային բյուրեղավանդակով, որի հանգույցներում են \((NH4)+\) կատիոնն ու թթվային մնացորդ անիոնը։
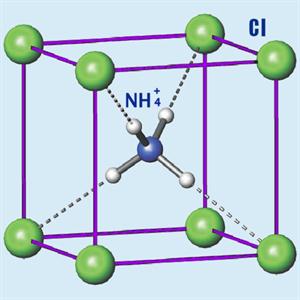
Ամոնիումի աղերը ջրում լուծելի են, ուժեղ էլեկտրոլիտներ են ու լրիվ դիսոցվում են:
Օրինակ՝ ամոնիումի նիտրատի դիսոցումը՝
Ամոնիումի աղերը փոխազդում են ալկալիների, թթուների և աղերի հետ՝
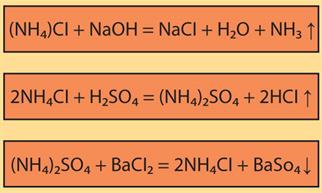
Ամոնիումի աղերի հայտաբերման ռեակցիան նրանց փոխազդեցությունն է ալկալիների հետ, որի հետևանքով ամոնիակ է անջատվում:
Ամոնիումի աղերը ենթարկվում են ջերմային քայքայման:
Օրինակ՝
Սակայն ամոնիումի նիտրատը քայքայվելիս ազոտի\((I)\) օքսիդ է առաջանում, իսկ ամոնիումի նիտրիտի քայքայումից՝ ազոտ.
Ամոնիումի երկքրոմատի քայքայումը նման է հրաբխի ժայթքման։

Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015