
















Ազոտի ստացումը և հատկությունները

Ազոտը բնության մեջ հանդիպում է երկու իզոտոպների ձևով՝
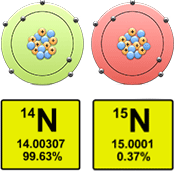
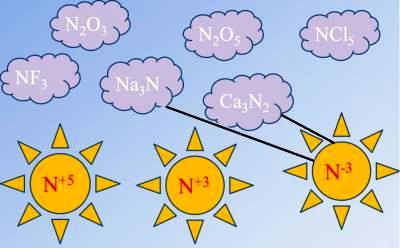
Միացություններում ազոտի հիմնական օքիդացման ատիճաններն են՝
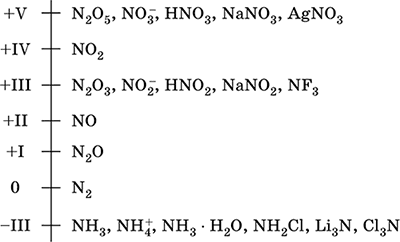
Պարզ նյութ՝ ազոտի մոլեկուլը առաջանում է այդ տարրի երկու ատոմի կենտ էլեկտրոնների զույգման շնորհիվ: Մոլեկուլում ատոմները կապված են կովալենտային ոչ բևեռային եռակի կապով, կապերից մեկը -կապ է, իսկ երկուսը՝
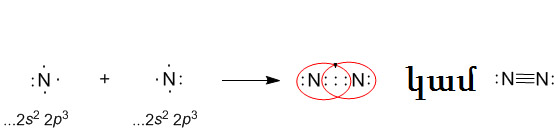
Մոլեկուլային բանաձևն է՝

Ֆիզիկական հատկությունները
Անհոտ, անհամ, ջրում քիչ լուծվող գազ է. \(100\ \)լ ջրում \((20°C) 1,54\ \)լ ազոտ է լուծվում։ \(–195,8 °C\) անգույն հեղուկ է, \(–209,86 °C\) ազոտը պնդանում է ձյան տեսքով: Օդից թեթև է մոտավորապես \(1,04 \) անգամ։



Ստացումը
Արդյունաբերության մեջ ազոտ ստանում են հեղուկ օդի կոտորակային թորումով (հեղուկ ազոտը եռում է ավելի ցածր ջերմաստիճանում, քան հեղուկ թթվածինը)։
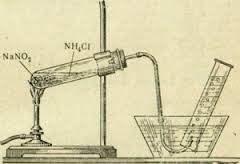
Լաբորատորիայում ազոտ ստանում են ամոնիումային աղերի ու նիտրիտների խառնուրդի տաքացմամբ:
Оրինակ՝
Քիմիական հատկությունները
Սովորական պայմաններում ազոտը քիմիապես ակտիվ չէ, ինչը հիմնականում պայմանավորված է մոլեկուլում առկա երեք կապով, որոնց ճեղքման համար մեծ քանակությամբ էներգիա է պահանջվում:
Ազոտը քիմիական նյութերի ճնշող մեծամասնության հետ փոխազդում է միայն խիստ պայմաններում (տաքացման, ճառագայթման, էլեկտրական պարպման պայմաններում կամ կատալիզատորի ներկայությամբ)։
Սովորական պայմաններում ազոտը չի փոխազդում ոչ մետաղների հետ:
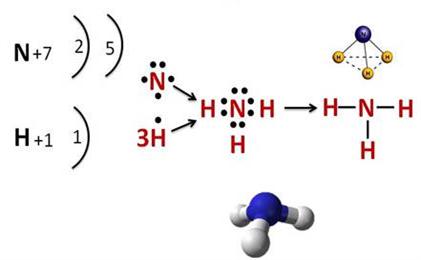
Ազոտի և ջրածնի փոխազդեցությունը
Ազոտը ջրածնի հետ փոխազդում է բարձր ճնշման տակ \((\)\(200-1000\ \)մթն\()\), \(450–500°C \) ջերմաստիճանում, երկաթ կատալիզատորի ներկայությամբ ու առաջացնում ցնդող ջրածնային միացություն՝ ամոնիակ \((\)\()\)
Ազոտի և թթվածնի փոխազդեցությունը
Ազոտը թթվածնի հետ փոխազդում է \(1200°C\)-ից բարձ ջերմաստիճանում առաջացնելով ազոտի\((II)\) օքսիդ: Նման փոխազդեցություն տեղի է ունենում ամպրոպների ընթացքում:

Ազոտի և մետաղների փոխազդեցությունը
Տաքացման պայմաններում ալկալիական ու հողալկալիական մետաղները և ազոտը փոխազդում են՝ առաջացնելով նիտրիդներ։
Միայն լիթիումը և ազոտն են փոխազդում համեմատաբար ցածր ջերմաստիճաններում (սենյակայինից փոքր-ինչ բարձր).
Նիտրիդներն աղանման նյութեր են՝

Նատրիումի նիտրիդ
Դրանք հեշտությամբ հիդրոլիզի են ենթարկվում:
Նշենք, որ իոնային կապով նիտրիդներ են առաջացնում միայն \(IA\) և \(IIA\) խմբերի մետաղները։
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015