
















Դիսոցման աստիճան, թույլ և ուժեղ էլեկտրոլիտներ:
Էլեկտրոլիտի դիսոցման աստիճանը էլեկտրոլիտի տրոհված մոլեկուլների թվի՝ և լուծված էլեկտրոլիտի մոլեկուլների թվի` հարաբերությունն է.
Դիսոցման աստիճանը կախված է էլեկտրոլիտի բնույթից:
Ուժեղ են այն էլեկտրոլիտները, որոնք ջրում լուծելիս գրեթե լրիվ դիսոցվում են իոնների:
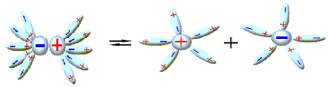
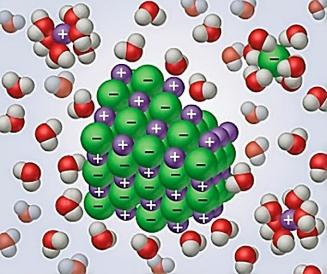
Ուժեղ էլեկտրոլիտների դիսոցման աստիճանը մոտ է մեկին (կամ՝ \(100\) %-ին):
Ուժեղ էլեկտրոլիտները նոսրացնելիս էլեկտրահաղորդականությունը մեծանում է չնչին չափով, այն էլ իոնների շարժման արագության մեծացման հաշվին:
Էլեկտրահաղորդականություն ստուգող սարքի լամպը գրեթե նույն պայծառությամբ է վառվում ուժեղ էլեկտրոլիտի թե՛ խիտ, և թե՛ նոսր լուծույթներում:
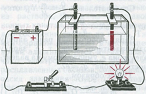
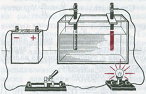
ուժեղ էլեկտրոլիտի խիտ լուծույթ ուժեղ էլեկտրոլիտի նոսր լուծույթ
Ուժեղ էլեկրոլիտների շարքում են դասվում.
*բոլոր լուծելի աղերը. օրինակ.
*որոշ թթուներ. և այլն.
Ի դեպ, եթե տարրը մի քանի թթվածնավոր թթու է առաջացնում, ապա որպես էլկտրոլիտ առավել ուժեղ է այն թթուն, որում տարրի օքսիդացման աստիճանը ավելի մեծ է:
*ալկալիները. և այլն.
Թույլ են այն էլեկտրոլիտները, որոնք ջրում լուծելիս մասամբ են դիսոցվում իոնների:
Օրինակ, եթե էլեկտրահաղորդականություն ստուգող սարքի էլեկտրոդները ընկղմենք անջուր քացախաթթվվի կամ թորած ջրի մեջ, ապա՝ լամպը չի վառվի (նկ.\(3\)). եթե նույն ձևով փորձարկենք քացախաթթվի խիտ լուծույթը, ապա կնկատենք, որ լամպը աղոտ է վառվում (նկ.\(2\)), իսկ նոսր լուծույթում՝ ավելի պայծառ է վառվում (նկ.\(1\)):

նկ\(.1\) նկ.\(2\) նկ.\(3\)
Թույլ էլեկտրոլիտների շարքին են դասվում.
*թույլ թթուները՝ և այլն
*չլուծվող հիմքերն ու ամոնիակը (ամոնիումի հիդրօքսիդը)
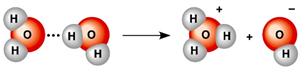
*ջուրը՝

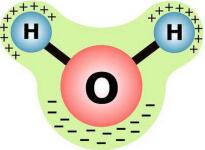
Ջուրն աննշան չափով դիսոցվում է ջրածնի՝ և հիդրօքսիդ՝ իոնների՝ կամ՝ ավելի ճիշտ հիդրօքսոնիում՝ և հիդրօքսիդ՝ իոնների.

Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015