
















Թթուներ: Հիմքեր: Աղեր
Բոլոր լուծելի թթուները, հիմքերը և աղերը էլեկտրոլիտներ են: Ջրում լուծելիս դրանք դիսոցվում են դրական և բացասական իոնների.
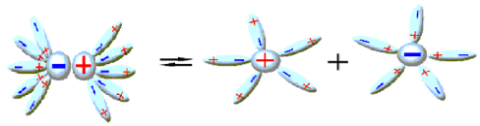
Ի՞նչն է ընդհանուրը միացությունների նույն դասին պատկանող էլեկտրոլիտների դիսոցման գործընթացում:
Նախորդ բաժիններից դու արդեն գիտես. քլորաջրածին գազը ջրում լուծելիս դիպոլ-դիպոլային փոխազդեցության հետևանքով այն դիսոցվում է՝ ըստ հետևյալ հավասարման. , առաջացնելով ջրածնի կատիոն և քլորիդ անիոն:
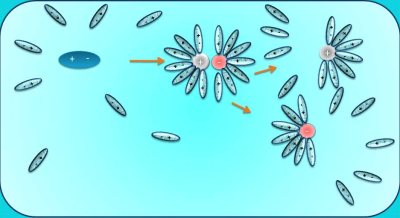
Նույն կերպ են դիսոցվում նաև մյուս թթուները, օրինակ. , հետևաբար.
Թթուներն այն էլեկտրոլիտներն են, որոնց դիսոցումից ստացվում են ջրածնի կատիոններ ու թթվային մնացորդի անիոններ:
Ուշադրություն
Ջրային լուծույթներում թթուների բոլոր ընդհանուր հատկությունները պայմանավորված են ջրածնի հիդրատացված կատիոնների առկայությամբ:
Ջրածնի կատիոնները թթուների ջրային լուծույթներում հիդրատացվում են, վերածվելով հիդրօքսոնիում իոնների.
Հետևաբար թթուների դիսոցման հավասարումները ավելի ճշգրիտ ձևով ներկայացվում են ջրի մոլեկուլների մասնակցությամբ. օրինակ՝
, կամ
Ըստ դիսոցման ժամանակ առաջացած ջրածնի կատիոնների թվի՝ թթուները լինում են.
միահիմն՝ և այլն,
երկհիմն՝ և այլն,
եռահիմն՝ և այլն,
քառահիմն՝ և այլն:
Որոշ դեպքերում թթվի մոլեկուլում առկա ջրածնի ատոմների թիվը չի համընկնում թթվի հիմնայնության հետ. օրինակ -ը միահիմն թթու է, թեև նրա մոլեկուլում ջրածնի չորս ատոմներ կան, իսկ -ը երկհիմն թթու է:
Բազմահիմն թթուները դիսոցվում են աստիճանաբար, օրինակ.
Ընդ որում առաջին փուլի դիսոցումն ընթանում է ավելի մեծ չափով:
Նույն տարրի առաջացրած թթվածնավոր թթուներից առավել ուժեղ էլեկտրոլիտ է տարրի առավել մեծ օքսիդացման աստիճանին համապատասխանող թթուն:
Օրինակ՝ ծծմբական թթուն ուժեղ թթու է, իսկ ծծմբայինը՝ թույլ:
Համեմատելով հիմքերի դիսոցման հավասարումները՝
, կարելի է եզրակացնել.
Հիմքերն այն էլեկտրոլիտներն են, որոնց դիսոցումից առաջանում են մետաղի (ամոնիումի) կատիոններ և հիդրօքսիդ՝ անիոններ:
Ուշադրություն
Ջրային լուծույթներում հիմքերի բոլոր ընդհանուր հատկությունները պայմանավորված են հիդրօքսիդ անիոնների առկայությամբ:
Օքսիդացման \(+2\) (և ավելի) աստիճան դրսևորող մետաղների հիդրօքսիդները՝ բազմաթթու հիմքերը դիսոցվում են աստիճանաբար:
Օրինակ՝
\(I\) փուլ
\(II\) փուլ
ընդ որում առաջին փուլի դիսոցումն ընթանում է ավելի մեծ չափով:
Տարբեր աղերի դիսոցման հավասարումները համեմատելով՝
կարող ենք եզրակացնել.
Աղերն էլեկտրոլիտներ են, որոնք դիսոցվելիս առաջացնում են մետաղի (ամոնիումի) կատիոններ և թթվային մնացորդի անիոններ:
Ուշադրություն
Ի տարբերություն բազմահիմն թթուների և բազմաթթու հիմքերի, աղերը դիսոցվում են անմիջապես ու լրիվ, այդ էլեկտրոլիտներն ատիճանաբար չեն դիսոցվում:
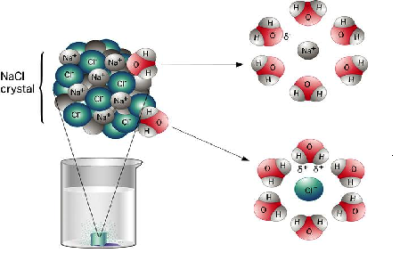
Աղերն ընդհանուր հատկություններ չունեն. աղերի հատկությունները պայամանավորված են և՛ կատիոններով, և՛ անիոններով:
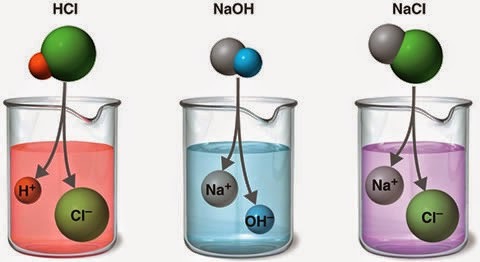
Թթուների, հիմքերի և աղերի անգույն լուծույթները միմյանցից կարելի է տարբերել թթվահիմնային հայտանյութերի միջոցով:
Օրինակ՝ լակմուսը թթուների ջրային լուծույթում ձեռք է բերում կարմիր գույն, հիմքերում՝ կապույտ, իսկ չհիդրոլիզվող աղերի ջրային լուծույթում պահպանում է իր գույնը՝ մանուշակագույնը.
Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015