
















Օքսիդացման-վերականգնման ռեակցիաներ:
Այն ռեակցիաները, որոնք ընթանում են նյութերի բաղադրության մեջ առկա տարրերի ատոմների օքսիդացման աստիճանների փոփոխությամբ, անվանում են օքսիդացման-վերականգնման ռեակցիաներ:
Այդ ռեակցիաների ընթացքը պայմանավորված է էլեկտրոնի անցմամբ մեկ ատոմից (իոնից, մոլեկուլից) մյուսին, ինչի հետևանքով էլ օքսիդացման աստիճանի փոփոխություն է տեղի ունենում:
Այն նյութերը, որոնց մոլեկուլներն իրենց օքսիդացմաան աստիճանը փոքրացնող ատոմներ են պարունակում, անվանում են օքսիդացնողներ (օքսիդիչներ), իսկ իրենց օքսիդացման աստիճանը մեծացնող ատոմներ պարունակող նյութերը՝ վերականգնողներ (վերականգնիչներ):
Վերականգնիչը տրամադրում է էլեկտրոն, մեծացնում է իր օքսիդացման ասստիճանը, օքսիդանում է.
Օքսիդիչը ընդունում է էլեկտրոն, փոքրացնում է իր օքսիդացման ասստիճանը, վերկանգնվում է:
Օրինակ
Մագնեզիումի այրման ռեակցիայի հավասարումը թթվածնում հետևյալն է.
այդ ռեակցիայի հավասարումը կարելի է ներկայացնել հետևյալ կիսառեակցիաների միջոցով.
ա. օքսիդացում.
բ. վերականգնում.
Ինչպե՞ս են կազմում և հավասարեցնում օքսիդավերականգնման ռեակցիաները:
Ինչպես բոլոր ռեակցիաների հավասարումների կազմումը, օքսիդավերականգնման ռեակցիաները նույնպես, առաջին հերթին, հիմնված են զանգվածի պահպանման օրենքի վրա, ապա՝ լիցքի պահպանման սկզբունքի հիման վրա:
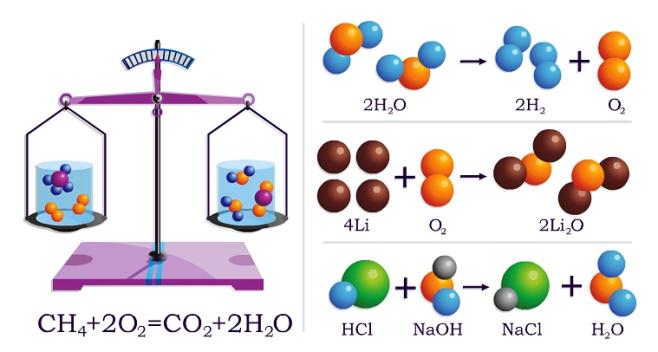
Զանգվածի պահպանման օրենքի ճշմարտացիությունն ակնհայտ է. բոլոր օրինակներում հավասարումների աջ և ձախ մասերում ատոմների թվերը հավասար են:
Լիցքի պահպանման սկզբունքից հետևում է, որ վերականգնիչի տրամադրած էլեկտրոնների թիվը պետք է հավասար լինի օքսիդիչի ընդունած էլեկտրոնների թվին:
Օրինակ` մեթանի այրման ռեակցիայում վերականգնիչ տարրը տրամաադրել է \(8\) էլեկտրոն.
,
իսկ օքսիդիչ նյութի՝ թթվածնի երկու մոլեկուլներն ընդունել են նույնպես \(8\) էլեկտրոն.
Գործնականում լիցքի պահպանման սկզբունքը կիրառելու համար պետք է իրականացնել էլեկտրոնային հաշվեկշիռ և գտնել անհրաժեշտ գործակիցներ:
Օքսիդավերականգնման ռեակցիաները կազմում և հավասարեցնում են, հիմնականում, ըստ հետևյալ քայլաշարի.(ֆոսֆորի և կալիումի քլորատի փոխազդեցության օրինակով)
*գրել համապատասխան ռեակցիայի ուրվագիրը
*նշել փոփոխման ենթարկված տարրերի օքսիդացման աստիճանները
*գրել վերականգնիչի օքսիդացման և օքսիդիչի վրականգնման կիսառեակցիաների հավասարումները
վերականգնիչ՝
օքսիդիչ՝
*գտնել վերականգնիչի տրամադրած և օքսիդիչի ընդունած էլեկտրոնների թվերի ամենափոքր ընդհանուր բազմապատիկը (փոխանցված էլեկտրոնների ընդհանուր թիվը)` \(30\) և բաժանելով այն էլեկտրոնների նշված թվերի վրա՝ գտնել «գլխավոր» գործակիցները` \(6\) և \(5\), նշել գործընթացը՝ օքսիդացում և վերականգնում.
վերականգնիչ՝ \(6 \) օքսիդացում
\(30\)
օքսիդիչ՝ \( 5 \) վերականգնում
*տեղադրել «գլխավոր» գործակիցները
*գտնել մնացած գործակիցները պարզ հաշվարկով.
բերված օրինակում՝ ըստ ֆոսֆորի ատոմների թվի. \(6 : 2 = 3\) և գրել հավասարումը վերջնական տեսքով.
Ի դեպ՝ օքսիդավերականգնման ռեակցիաները քիմիական երևույթների հատուկ դաս են, սակայն նրանց մի մասը հնարավոր է դասակարգել նաև մեկ այլ հատկանիշի հիման վրա՝ ըստ ելանյութերի և վերջանյութերի թվի և բաղադրության փոփոխության հատկանիշի:
Դրանք զուգակցելով կարելի է եզրակացնել.
*բոլոր տեղակալման ռեակցիաները նաև օքսիդավերականգնման ռեակցիաներ են
*միացման և քայքայման ռեակցիաների մի մասն է օքսիդավերականգնման ռեակցիաներին պատկանում
*փոխանակման ռեակցիաները օքսիդավերականգնման ռեակցիաներ չեն:
Եթե տարրի ատոմն միացությունում ցուցաբերում է բարձրագույն օքսիդացման աստիճան, ապա այն կարող է լինել միայն օքսիդիչ՝ էլեկտրոն վերցնող. օրինակ՝ և այլն:
Եթե տարրի ատոմն ունի ցածրագույն օքսիդացման աստիճան, ապա այն կարող է լինել միայն վերականգնիչ՝ էլեկտրոն տրամադրող. օրինակ՝ և այլն:
Եթե տարրի ատոմն ունի միջանկյալ օքսիդացման աստիճան, ապա այն կարող է դրսևորել վերօքս երկակիություն՝ լինել և՛ օքսիդիչ, և՛վերականգնիչ.
օրինակ՝ և այլն:
Օքսիդավերականգնման ռեակցիաները լայնորեն տարածված են մեր շրջապատում:
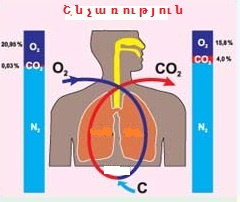
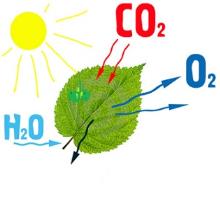
Բազմաթիվ բնական երևույթներ՝ շնչառություն, ֆոտոսինթեզ, հրաբուխ և այլն օքսիդավերականգնման ռեակցիաներ են.

Կարևոր օքսիդիչներ են. և այլն.
Կարևոր վերականգնիչներ են. և այլն:

Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015