
















Աղերի հիդրոլիզը:
Աղի հիդրոլիզը աղի և ջրի մոլեկուլների միջև ընթացող իոնափոխանակային ռեակցիա է, որի հետևանքով թույլ էլեկտրոլիտի առաջացման պատճառով միջավայրում փոխվում են և իոնների քանակները:
թթվային | չեզոք | հիմնային | |
լակմուս | կարմիր | մանուշակագույն | կապույտ |
մեթիլնարնջագույն | կարմիր | դեղին | դեղին |
| ֆենոլֆտալեին | անգույն | անգույն | մորեգույն |
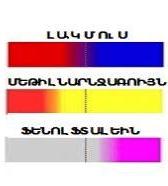
Կան բազմաթիվ բնական (օրինակ հաղարջը) և սինթետիկ թթվահիմնային հայտանյութեր: Կան նաև դրանց խառնուրդներից պատրաստված տարբեր ունիվերսալ հայտանյութեր, որոնք ցույց են տալիս ոչ միայն լուծույթի թթվայնությունը, այլ նաև թթվայնության չափը:


Թեմայի քննարկումը կատարենք փորձերի արդյունքների պրոբլեմահարույց պատասխանների պարզաբանման միջոցով. դիտարկենք լակմուսի գույնը չորս տարբեր չեզոքաղերի ջրային լուծույթներում:
| փորձի համարը | \(1\) | \(2\) | \(3\) | \(4\) |
| աղի բանաձևը | ||||
| լակմուսի գույնը | մանուշակագույն | կապույտ | կարմիր | մանուշակագույն |
Ինչու՞ է կապույտ գույն -ի լուծույթում (գ). չէ՞ որ իոններ այդ աղի բաղադրությունում չկան, կամ՝ ինչու՞ է կարմիր գույն -ի ջրային լուծույթում (ա). չէ՞ որ իոններ այդ աղի բաղադրությունում չկան:

Վերհիշեենք. ցանկացած աղ կարելի է դիտել որպես հիմքի և թթվի միջև ընթացող չեզոքացման ռեակցիայի արգասիք. այդ առումով բոլոր աղերը ստորաբաժանվում են չորս խմբի:
Երկրորդ աղյուսակում բերված են այդ ստորաբաժանմանը համապատասխանող օրինակներ:
Փորձ \(1\). -ը ուժեղ հիմքից` և ուժեղ թթվից` առաջացած աղ է: Այն ջրում լուծվում և դիսոցվում է իոն-դիպոլային մեխանիզմով.
. առաջանում են և հիդրատացված իոններ, որոնք քիմիապես չեն փոխազդում ջրի մոլեկուլների հետ, այսինքն՝ չեն հիդրոլիզվում և և իոնների քանակները լուծույթում չեն փոփոխվում:
Լուծելի աղերը, որոնք ուժեղ հիմքից և ուժեղ թթվից են առաջացել, ջրում չեն հիդրոլիզվում: Այդ աղերի ջրային լուծույթներն ունեն չեզոք միջավայր:
Փորձ \(2\). -ը ուժեղ հիմքից՝ և թույլ թթվից՝ առաջացած աղ է: Այն ջրում լուծելիս դիսոցվում է իոն-դիպոլային մեխանիզմով.
. առաջանելով և հիդրատացված իոններ:
Այդ փոխազդեցության հետևանքով ջրի մոլեկուլները լրացուցիչ բևեռացման են ենթարկվում,որի հետևանքով ինչ-որ չափով կապ է ճեղքվում և նոր կապ է առաջանում (հիշի՛ր -ը թույլ թթու է), իսկ կապ չի առաջանում (հիշի՛ր -ը ուժեղ հիմք է), լուծույթում իոններ են կուտակվում, որոնք էլ պայմանավորում են միջավայրի հիմնային ռեակցիան և լակմուսի կապտելը.
Այսպիսի գործընթացն անվանում են հիդրոլիզ (ջրատարրալուծում):
Ուժեղ հիմքից և թույլ թթվից առաջացած աղերը ջրային լուծույթում հիդրոլիզվում են: Այդ աղերի ջրային լուծույթներում միջավայրը հիմնային է:
Փորձ \(3\). -ը թույլ հիմքից՝ և ուժեղ թթվից՝ առաջացած աղ է, այն, ինչպես բոլոր լուծելի աղերը, լուծվում և դիսոցվում է իոն-դիպոլային մեխանիզմով.
Առաջացած իոնները փոխազդում են ջրի բևեռացած մոլեկուլների հետ, առաջացնելով թույլ էլեկտրոլիտ՝ .
, իսկ իոնները ջրի մոլեկուլների հետ չեն փոխազդում, միջավայրում կուտակվում են իոններ, որոնք էլ պայմանավորում են միջավայրի թթվային ռեակցիան, և լակմուսը կարմրում է:
Թույլ հիմքից և ուժեղ թթվից առաջացած աղերը ջրային լուծույթում հիդրոլիզվում են: Այդ աղերի ջրային լուծույթներում միջավայրը թթվային է:
Նկարում բերված են լակմուսի ձեռք բերած գույները (ա).թթվային, (բ).չեզոք և (գ).հիմնային միջավայրերում՝ համապատասխանաբար.

Փորձ \(4\). -ը թույլ հիմքից՝ և թույլ թթվից՝ առաջացած աղ է, ջրային լուծույթում դիսոցվում է ըստ հետևյալ հավասարման.
առաջացած և՛ , և՛ իոնները փոխազդում են ջրի մոլեկուլների հետ.
առաջացնելով թույլ թթու՝ և թույլ հիմք՝ , սակայն արդյունքում և իոնների էական կուտակում չի առաջանում և լակմուսի գույնը մնում է մանուշակագույն:
Թույլ հիմքից և թույլ թթվից առաջացած աղերը կրկնակի են հիդրոլիզվում, սակայն միջավայրի ռեակցիան էական չի փոփոխվում. այն որոշվում է առաջացած թույլ հիմքի և թույլ թթվի համեմատական ուժով:
Այսպիսի աղերից են և այլն:
Աղերի հիդրոլիզը ընդունված է ներկայացնել ռեակցիաների հավասարումների հետևյալ քայլաշարով.
ա. աղի դիսոցման հավասարում
բ. աղի հիդրոլիզի կրճատ իոնային հավասարում
գ. աղի հիդրոլիզի լրիվ իոնային հավասարում
դ. աղի հիդրոլիզի մոլեկուլային հավասարում.
Օրինակ
ա.
բ.
գ.
դ.
Սենյակային ջերմաստիճանում, որպես կանոն, հիդրոլիզն ընթանում է առաջին փուլով:
Օրինակ
Հայտնի են աղեր, որոնք ջրային լուծույթում գոյություն չունեն, քանի որ հիդրոլիզվում են միանգամից, լրիվությամբ.
Օրինակ
Այսպիսի աղերից են և այլն:
Աղի հիդրոլիզի խորությունը (աստիճանը) մեծանում է աղի լուծույթը նոսրացնելիս և ջերմաստիճանը բարձրացնելիս, քանի որ աղի հիդրոլիզը ջերմակլանիչ և դարձելի գործընթաց է:

Աղբյուրները
Լ.Ա.Սահակյան և ուրիշներ, քիմիա 9, Երևան 2015