
















Քիմիական ռեակցիաներ առաջանալու համար անհրաժեշտ է, որ նյութերը անմիջական հպման մեջ լինեն: Այդ նպատակով նյութերը մանրացնում են և խառնում:
Օրինակ` ծծմբի և երկաթի միջև ռեակցիան ընթանալու համար ծծումբը տրորում են հավանգում, իսկ երկաթի փոշին ստանում են հատուկ եղանակով: Ստացված փոշիները խնամքով խառնում են` մասնիկների հավասարաչափ բաշխման համար:


Ծծմբի փոշի Երկաթի փոշի
Նյութի առավել նուրբ մանրացում` մինչև մոլեկուլ և իոն, հնարավոր է դրանք ջրում լուծելով, որի պատճառով էլ ռեակցիաների մեծ մասն իրականացվում է լուծույթներում:


Լուծույթներում իրականացված ռեակցիաները
Որպեսզի ռեակցիան սկսվի, անհրաժեշտ է ինչ որ ձևով այն խթանել, «արթնացնել» քիմիական կապերը: Դա է պատճառը, որ քիմիական ռեակցիաների մեծ մասի ընթանալու համար ջերմություն է պահանջվում:

Տաքացման պայմանում ընթացող ռեակցիա
Այսպիսով, ռեակցիան սկսելու և ընթանալու պայմաններն են՝
1. մանրացում 2. խառնում 3. տաքացում և այլն:
Անհրաժեշտ է հստակ տարբերել ռեակցիան «սկսելու» և ռեակցիայի «ընթանալու» պայմանները: Օրինակ` ջուրը քայքայելու համար էլեկտրական հոսանք անհրաժեշտ է ոչ միայն սկզբում, այլև ռեակցիայի ամբողջ ընթացքում, այլ կերպ ռեակցիան կդադարի ընթանալ: Այս օրինակում էլեկտրական հոսանքը ռեակցիայի և' սկսվելու, և' ընթանալու պայմանն է:
Երկաթի և ծծմբի փոխազդեցության համար պահանջվում է միայն սկզբնական տաքացում, որից հետո ռեակցիան ընթանում է մեծ քանակությամբ լույսի ու ջերմության անջատումով, և տաքացում չի պահանջվում: Այս օրինակում տաքացումը միայն ռեակցիան սկսելու պայմանն է:
Բազմաթիվ քիմիական ռեակցիաներ կարող են ընթանալ սովորական պայմաններում: Օրինակ` կալիում (\(K\)) ալկալիական մետաղը և ջուրը սենյակային ջերմաստիճանում բուռն փոխազդում են, ընդ որում` պայթյունով:
Սակայն բազմաթիվ քիմիական ռեակցիաներ սովորական պայմաններում չեն ընթանում ու կարող են սկսվել միայն հատուկ պայմանների` բարձր ջերմաստիճանի, ճնշման, հաստատուն էլեկտրական հոսանքի, լույսի, խոնավության և այլ պայմանների առկայության դեպքում:
Օրինակ` ալյումինի ( \(Al\) ) փոշին սովորական ջերմաստիճանում չի բռնկվում, սակայն մինչև \(700°\)\(C\) տաքացնելիս այրվում է կուրացնող բոցով:

Ալյումինի այրումը թթվածնում
Երկաթը (\(Fe\)) ժանգոտվում է միայն խոնավ օդում` ջրի և թթվածնի հետ միանալիս, երբ առաջանում է ժանգ անվանվող գորշ, փխրուն զանգված:

Երկաթի ժանգոտումը
Քիմիական ռեակցիաները, որպես կանոն, ուղեկցվում են կամ ջերմության անջատում (օրինակ այրումը), կամ կլանումով (օրինակ`քայքայման ռեակցիաներից շատերը): Այդպիսի ռեակցիաները տարբերակելը խիստ կարևոր է քիմիական փորձեր ծրագրելիս ու կատարելիս:


Ջերմանջատիչ ռեակցիա՝ այրման Ջերմակլանիչ ռեակցիա՝ քայքայման
Քիմիայի այն բաժինը, որն ուսումնասիրում է քիմիական ռեակցիաները դրանք ուղեկցող ջերմային երևույթների տեսանկյունից, անվանվում է ջերմաքիմիա:
Ջերմության այն քանակը, որը քիմիական ռեակցիայի ընթացքում անջատվում է կամ կլանվում, անվանվում է ռեակցիայի ջերմէֆեկտ, նշանակվում լատիներեն \(Q\) տառով և միավորների միջազգային համակարգում արտահայտվում է ջոուլներով \((Ջ\)):
Գործնական հաշվարկներում առավել կիրառական միավորն է կիլոջոուլը՝ \((կՋ)` \)\(1\ կՋ = 1000\ Ջ\) 
Ջերմաքիմիական հավասարումներում նյութերի քիմիական բանաձևերից ու ռեակցիայի ջերմությունից բացի` նշում են նաև այդ նյութերի ագրեգատային վիճակները` պինդ (պ), հեղուկ (հ), գազային (գ): Դրա անհրաժեշտությունը պայմանավորված է այն հանգամանքով, որ ռեակցիայի ջերմէֆեկտի մեծությունը կախված է նաև ռեակցիային մասնակցող նյութերի ագրեգատային վիճակից: Նյութի մի ագրեգատային վիճակից մյուսին անցումը նույնպես ուղեկցվում է էներգիայի փոփոխությամբ:
Ռեակցիաների այն հավասարումները, որոնցում նշվում է ռեակցիայի ջերմէֆեկտը`անջատված կամ կլանված ջերմության քանակը, կոչվում են ջերմաքիմիական:
Քիմիական ռեակցիայի ընթացքում անջատված ջերմությունը նշանակվում է \(+Q\), իսկ կլանված ջերմությունը` \(-Q\) (երկու դեպքում էլ դա գրանցվում է քիմիական հավասարման աջ կողմում' վերջանյութերի բանաձևերից հետո): Այսպիսով, ռեակցիայի ջերմէֆեկտի տեսանկյունից` քիմիական ռեակցիաները լինում են ջերմանջատիչ (էկզոթերմային) և ջերմակլանիչ (էնդոթերմային):
Քիմիական այն ռեակցիաները, որոնց ընթանալն ուղեկցվում է ջերմության անջատումով, կոչվում են ջերմանջատիչ ռեակցիաներ:
Օրինակ՝ մեթանի այրումը

Քիմիական այն ռեակցիաները, որոնց ընթանալն ուղեկցվում է ջերմության կլանումով, կոչվում են ջերմակլանիչ ռեակցիաներ:
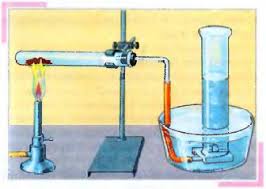
Օրինակ՝ կալիումի պերմանգանատի քայքայումը:

Ջերմաքիմիական հավասարումներում նյութերի քիմիական բանաձևերից ու ռեակցիայի ջերմությունից բացի` նշում են նաև այդ նյութերի ագրեգատային վիճակները` պինդ (պ), հեղուկ (հ), գազային (գ): Դրա անհրաժեշտությունը պայմանավորված է այն հանգամանքով, որ ռեակցիայի ջերմէֆեկտի մեծությունը կախված է նաև ռեակցիային մասնակցող նյութերի ագրեգատային վիճակից: Նյութի մի ագրեգատային վիճակից մյուսին անցումը նույնպես ուղեկցվում է էներգիայի փոփոխությամբ:
Օրինակ՝
Աղբյուրները
Լ.Ա. Սահակյան, Ք.Հ. Բդոյան . Քիմիա 8 . Երևան . 2014