
















Նյութի գազային վիճակը
Նյութի գազային վիճակը, ի տարբերություն նյութի հեղուկ և պինդ ագրեգատային վիճակների, բնութագրվում է մեծ սեղմելիությամբ, փոքր խտությամբ, դիֆուզիայի մեծ արագությամբ և այլն:
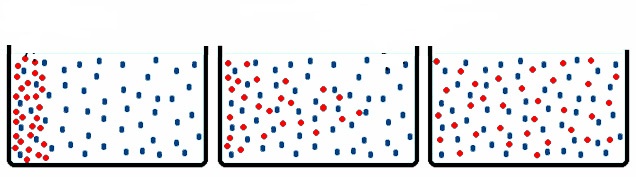
Այդ է պատճառը, որ կան մի շարք օրենքներ և օրինաչափություններ, որոնք հատուկ են միայն նյութի գազային վիճակին:
Օրինակ՝ Բոյլ-Մարիոտի օրենքը կապ է ստեղծում գազի ճնշման և ծավալի միջև՝ հաստատուն ջերմաստիճանի պայմաններում: Ըստ այդ օրենքի միևնույն ջերմաստիճանի պայմաններում որոշակի զանգվածով գազի ծավալը հակադարձ համեմատական է գազի ճնշմանը.
:
Գեյ-Լյուսակի օրենքը կապ է ստեղծում գազի ծավալի և ջերմաստիճանի միջև՝ միևնույն ճնշման պայմաններում:
Շառլի օրենքով կապ է հաստատվում գազի ճնշման և ջերմաստիճանի միջև՝ հաստատուն ծավալի պայմաններում:
Ըստ Ավոգադրոյի օրենքի՝ միատեսակ պայմաններում \((P, T)\) տարբեր գազերի հավասար ծավալներում պարունակվում են հավասար թվով մոլեկուլներ. :
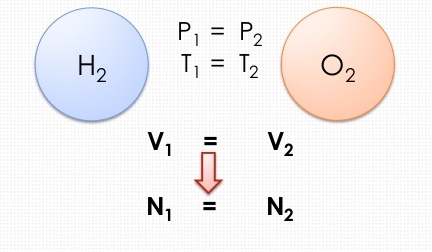
Ավոգադրոյի օրենքից բխում են կարևոր հետևություններ:
* Մեկ մոլ քանակով գազի ծավալը կոչվում է գազի մոլային ծավալ՝ , նորմալ պայմաններում \(=22,4\) լ/մոլ:

* Գազի հարաբերական խտությունը՝ \(D\) միևնույն ծավալով երկու գազերի զանգվածների հարաբերությունն է: Առաջին գազի հարաբերական խտությունն ըստ երկրորդ գազի հավասար է նրանց մոլային զանգվածների հարաբերությանը:
Օրինակ՝
* Գազի խտությունը նրա մոլային զանգվածի և մոլային ծավալի հարաբերությունն է և ունի գ/լ չափողականություն:
* Գազերի խառնուրդի միջին մոլային զանգվածը որոշվում է ըստ հետևյալ բանաձևի՝
,
որտեղ \(M\)-երը յուրաքանչյուր գազի մոլային զանգվածն է, իսկ \(a\)-երը կարող են լինել ծավալներ, քանակներ, մոլեկուլների թվեր, ծավալային բաժիններ, մոլային բաժիններ:
* Գազերի մասնակցությամբ ռեակցիաների հավասարումներում քանակաչափական գործակիցները ցույց են տալիս նաև գազերի ծավալների հարաբերություն: Օրինակ՝

Մենդելեև-Կլապեյրոնի հավասարումը կոչվում է գազի վիճակի հավասարում և կապ է ստեղծում տվյալ քանակով գազի ծավալի, ճնշման և ջերմաստիճանի միջև՝ , որտեղ \(R\)-ը գազային հաստատունն է: Այն թվապես հավասար է մոտ \(8,3\) Ջ/(մոլ·Կ), եթե ճնշումն արտահայտվի պասկալներով, իսկ ծավալը՝ խորանարդ մետրերով:

Աղբյուրները
Ա․ ԽԱՉԱՏՐՅԱՆ, Լ․ ՍԱՀԱԿՅԱՆ
Քիմիա-10, Երևան-2010