
















Լուծույթները և դրանց կոնցենտրացիաները

Լուծույթն այն համասեռ համակարգն է, որը բաղկացած է լուծիչից, լուծված նյութից և դրանց փոխազդեցության արգասիքներից:
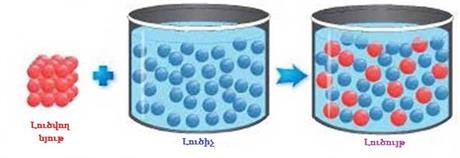
Ջուրը համընդհանուր լուծիչ է:

Ըստ ջրում լուծվելու հատկության նյութերը լինում են՝ լավ լուծվող, քիչ լուծվող և գործնականում չլուծվող:

Ջրում լավ են լուծվում իոնային և բևեռային կովալենտային կապերով միացությունները, և դա պայմանավորված է ջրի մոլեկուլների բևեռայնությամբ:
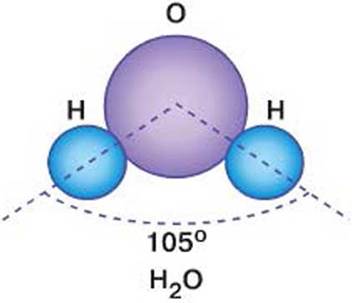
Լուծման գործընթացն ուղեկցվում է և՛ ֆիզիկական, և՛ քիմիական երևույթներով:
Օրինակ՝ պղնձարջասպը՝ , ջրում կամ ամոնիակաջրում լուծելիս ստացվում են տարբեր գույներ ունեցող լուծույթներ, ինչը վկայում է վերը ասվածը:

- Պինդ նյութերի լուծելիությունը, որպես կանոն, ջերմաստիճանի բարձրացման հետ մեծանում է, քանի որ այն ջերմակլանիչ և դարձելի գործընթաց է:
- Գազերի լուծելիությունը, որպես կանոն, ջերմաստիճանի բարձրացման հետ փոքրանում է, քանի որ այն ջերմանջատիչ և դարձելի գործընթաց է:
Ուշադրություն
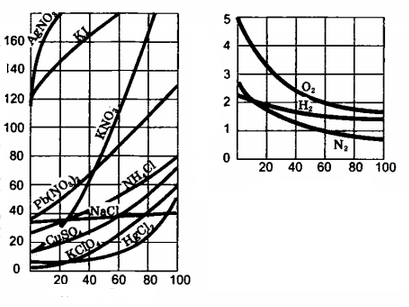
Ըստ լուծված նյութի և լուծիչի զանգվածների հարաբերակցության լուծույթները լինում եմ նոսր և խիտ: Յուրաքանչյուր նյութի որոշակի զանգված կարող է լուծվել տվյալ ծավալով կամ զանգվածով լուծիչում`տվյալ ջերմաստիճանի պայմաններում:
Ուշադրություն
- Եթե լուծույթը պարունակում է առավելագույն քանակով լուծված նյութ, ապա կոչվում է հագեցած:
- Եթե լուծույթը պարունակում է ավելի քիչ լուծված նյութ, քան համապատասխանում է հագեցած լուծույթին, ապա կոչվում է չհագեցած:
- Եթե լուծույթը պարունակում է ավելի շատ լուծված նյութ, քան համապատասխանում է հագեցած լուծույթին, ապա կոչվում է գերհագեցած:
Այդ լուծույթները չափազանց անկայուն են, և դրանց ստացման համար պահանջվում են հատուկ պայմաններ:
Հագեցած լուծույթի կոնցենտրացիայով որոշվում է տվյալ նյութի լուծելիությունը կամ լուծելիության գործակիցը:
Լուծելիությունը նյութի առավելագույն զանգվածն է (գ), որը կարող է լուծվել \(100\) գ ջրում՝ տվյալ ջերմաստիճանի պայմաններում.
Լուծույթների կոնցենտրացիայի արտահայտման բազմաթիվ ձևեր կան, որոնցից առավել կիրառելի են հետևյալները.
- Լուծված նյութի զանգվածային բաժինը լուծված նյութի զանգվածի հարաբերությունն է լուծույթի զանգվածին., կամ՝ \(·100\)%
- Լուծույթի մոլային կոնցենտրացիան լուծված նյութի քանակի հարաբերությունն է լուծույթի ծավալին. , որի չափողականությունն է մոլ/լ:
- Լուծված նյութի մոլային բաժինը լուծված նյութի քանակի հարաբերությունն է լուծիչի և լուծված նյութի քանակների գումարին. , կամ՝ \(·100\ \)%
Աղբյուրները
Ա․ ԽԱՉԱՏՐՅԱՆ, Լ․ ՍԱՀԱԿՅԱՆ
Քիմիա-10, Երևան-2010