
















Ատոմի էլեկտրոնային թաղանթի կառուցվածքը
Տարրերի ատոմներում էլեկտրոնները լրացվում են ըստ հետևյալ սկզբունքների.
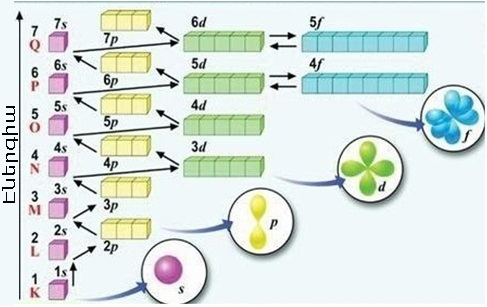
*Նվազագույն էներգիայի սկզբունք (Կլեչկովսկու կանոն):

Վ. Կլեչկովսկի
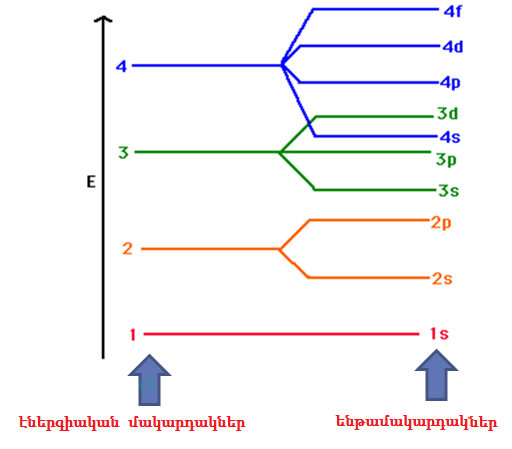
Ըստ որի էլեկտրոնային թաղանթում էլեկտրոնները լրացվում են ըստ գումարի աճի, ընդ որում որոշիչ է գլխավոր քվանտային թվի արժեքը:
Էլեկտրոնը նախ զբաղեցնում է ամենացածր էներգիական ենթամակարդակը՝ \(1s \)\((\)\()\), ապա՝ \(2s , 2p, 3s, 3p, 4s, 3d, 4p\) և այլն, ինչպես բերված է նկարում:
*Պաուլիի արգելման սկզբունք:

Վ. Պաուլի
Ըստ որի ատոմում չեն կարող լինել չորս քվանտային թվերի նույն արժեքներն ունեցող երկու էլեկտրոն կամ նույն քվանտային բջիջում կարող են գտնվել ամենաշատը երկու էլեկտրոն՝ հակառակ սպիններով:
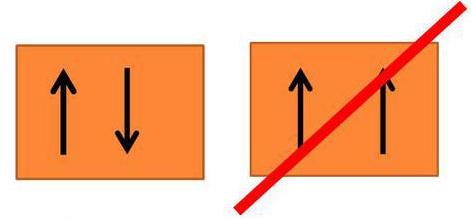
*Հունդի կանոն:

Հ. Հունդ
Ըստ Հունդի կանոնի տվյալ ենթամակարդակում էլեկտրոնները լրացվում են այնպես, որ սպինային քվանտային թվի գումարային արժեքն անցնի իր առավելագույն արժեքով կամ տվյալ ենթամակարդակում էլեկտրոնները նախ լրացվում են մեկական՝ նույն ուղղությամբ, ապա զույգվում են:
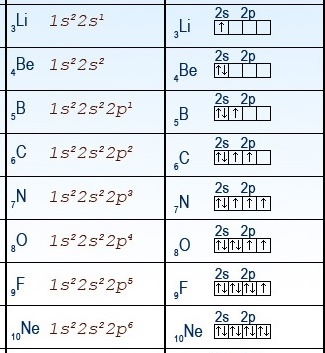
Օրինակ՝ երկրորդ պարբերության տարրերի ատոմների էլեկտրոնային բանաձևերը և էլեկտրոնաբջջային գծապատկերները բերված են նկարում:
Հաջորդ նկարում բերված է երրորդ պարբերության որոշ տարրերի ատոմներում էլեկտրոնների բաշխումն ըստ էներգիական մակարդակների, ենթամակարդակների, ապա ըստ օրբիտալների (քվանտային բջիջների):
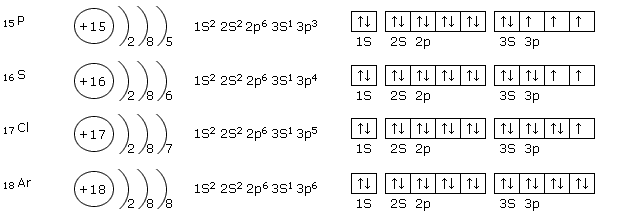
\(3p\) ենթամակարդակի լրացումից հետո, ըստ նվազագույն էներգիայի սկզբունքի, լրացվում է \(4s\) ենթամակարդակը (կալիում, կալցիում), ապա՝ \(3d\)-ն (սկանդիումից ցինկ):
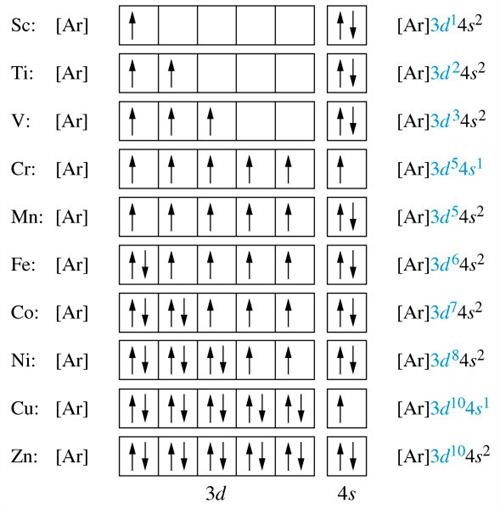
Ինչպես, հավանաբար, նկատեցիր նշված տարրերի էլեկտրոնային բանաձևերը տրված են համառոտ գրագրության ձևով՝ նախորդող իներտ գազի միջոցով:
Որոշ տարրերի ատոմներում դիտվում է, այսպես կոչված, «էլեկտրոնի անկում» երևույթը: Օրինակ քրոմի էլեկտրոնային բանաձևը է, ենթադրվող -ի փոխարեն:
Կամ պղնձի էլեկտրոնային բանաձևը է, ենթադրվող -ի փոխարեն: Սակայն այս «շեղումները» նույնպես բացատրվում են նվազագույն էներգիայի սկզբունքով՝ վիճակների առավել մեծ կայունությամբ:
Աղբյուրները
Ա․ ԽԱՉԱՏՐՅԱՆ, Լ․ ՍԱՀԱԿՅԱՆ
Քիմիա-10, Երևան-2010