
















Քվանտային թվերը-էլեկտրոնի բնութագրիչներ

Ըստ ժամանակակից պատկերացումների և ատոմի կառուցվածքի քվանտամեխանիկական մոդելի՝ էլեկտրոնի վիճակն ատոմում, այսինքն՝ էներգիան, օրբիտալի ձևը, չափը, տարածական կողմնորոշումը և այլն կարելի է ներկայացնել չորս քվանտային թվերի միջոցով:
-գլխավոր քվանտային թիվ, որ ցույց է տալիս.
* էլեկտրոնի էնեգիական մակարդակի համարը
* էլեկտրոնի էներգիան
* ատոմային օրբիտալի չափը
* էներգիական ենթամակարդակների թիվը տվյալ մակարդակում
-ն ընդունում է ամբողջ թվերի արժեքներ, որոնք ունեն նաև տառային նշանակումներ:

Գլխավոր քվանտային թվի արժեքները համընկնում են տարրերի պարբերական համակարգի պարբերությունների համարների հետ:
-օրբիտալային քվանտային թիվ:
- ն ընդունում է \(0\), \(1\), \(2\) և այլն, մինչև \(n-1\) ամբողջական արժեքներ, որոնք ունեն նաև տառային նշանակումներ:
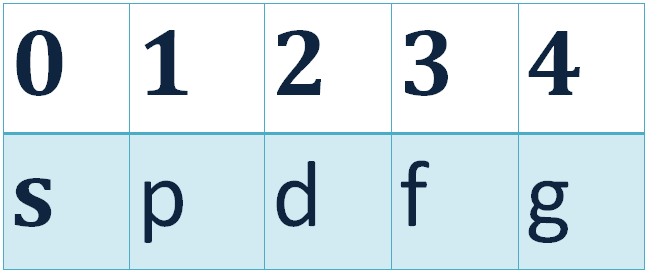
Դա նշանակում է, որ էներգիական մակարդակները բաժանվում են ենթամակարդակների, ընդ որում նշված շարքում էներգիան մեծանում է:
Օրբիտալային քվանտային թվի արժեքների քանակը կախված է գլխավոր քվանտային թվից և հավասար է դրան:
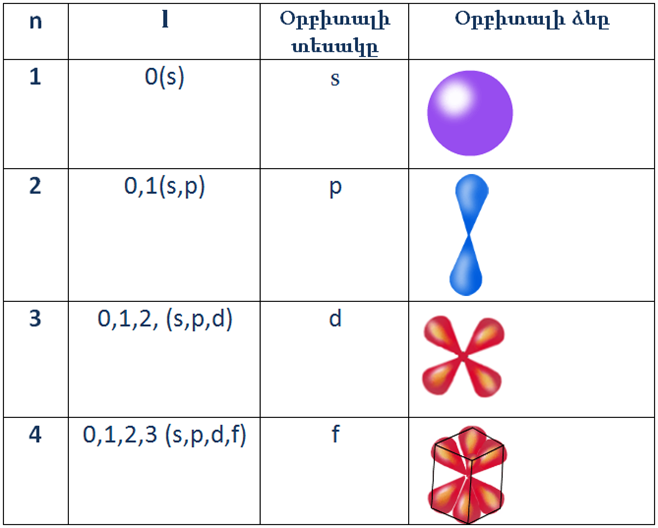
Առաջին էներգիական մակարդակն ունի մեկ ենթամակարդակ՝ \(s\)\(-\)ենթամակարդակ:
Երկրորդ էներգիական մակարդակն ունի երկու ենթամակարդակ՝ \(s\)\(-\) և \(p\)\(-\)ենթամակարդակներ:
Երրորդը՝ \(s\)\(-\), \(p\)\(-\) և \(d\)\(-\) ենթամակարդակներ:
Չորրորդը՝ \(s\)\(-\), \(p\)\(-\), \(d\)\(-\) և \(f\)\(-\) ենթամակարդակներ և այլն:
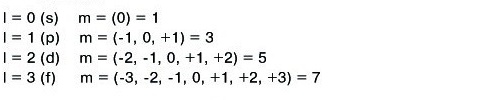
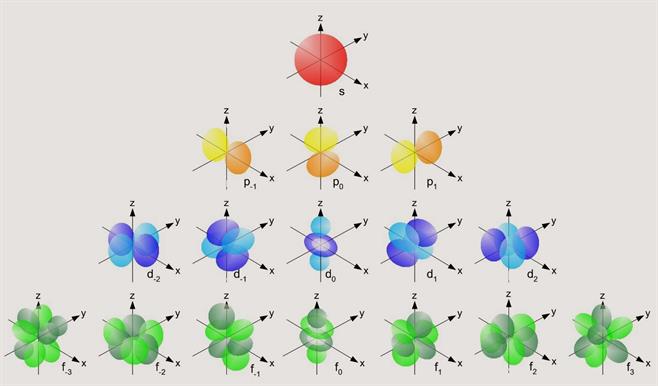
Տվյալ ենթամակարդակի էլեկտրոնները կոչվում են հենց այդ տառերով, օրինակ՝ \(s\)-էլեկտրոն:
-մագնիսական քվանտային թիվ:
Ցույց է տալիս օրբիտալի կողմնորոշումը տարածության մեջ և ընդունում է \(-\)-ից մինչև \(+\) ներառյալ նաև զրոն թվային արժեքներ, ընդհանուր առմամբ արժեքներ:
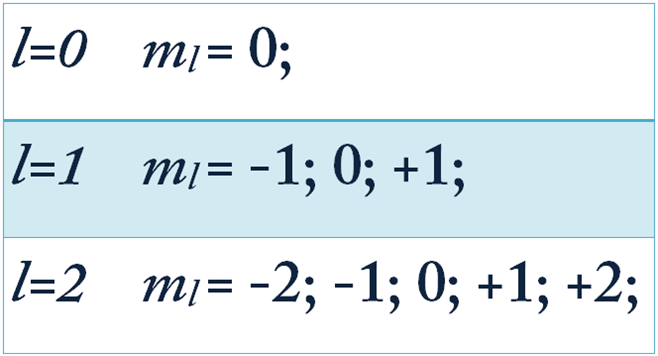
Միևնույն ենթամակարդակում գտնվող էլեկտրոնները ունեն նույն էներգիան, սակայն տարբերվում են տարածական կողմնորոշմամբ:
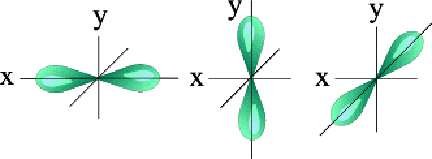
Ընդունված է -ի յուրաքանչյուր արժեք ունեցող օրբիտալը ներկայացնել մեկ վանդակի՝ քվանտային բջջի ձևով, ըստ որի՝
\(s\)\(-\)ենթամակարդակը կունենա մեկ քվանտային բջիջ
\(p\)\(-\)ենթամակարդակը՝ երեք,
\(d\)\(-\)ենթամակարդակը՝ հինգ,
\(f\)\(-\)ենթամակարդակը՝ յոթ և այլն:
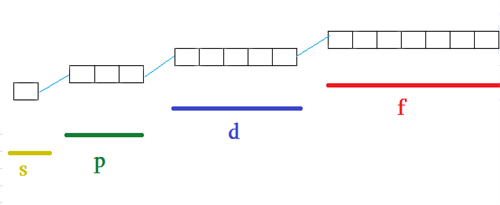
Ստացվում է, որ օրբիտալների ընդհանուր թիվը տվյալ էներգիական մակարդակում հավասար է գլխավոր քվանտային թվի քառակուսուն՝ :
Ըստ Պաուլիի սկզբունքի՝ յուրաքանչյուր օրբիտալ, անկախ նրա ձևից և չափից, կարող է ամենաշատը տեղավորել երկու էլեկտրոն:
Ստացվում է, որ էլեկտրոնների առավելագույն թիվը տվյալ էներգիական մակարդակում հավասար է գլխավոր քվանտային թվի կրկնակի քառակուսուն:

-սպինային քվանտային թիվ:
Ընդունում է երկու արժեք և ցույց է տալիս էլեկտրոնի պտույտի ուղղությունն իր առանցքի շուրջ:
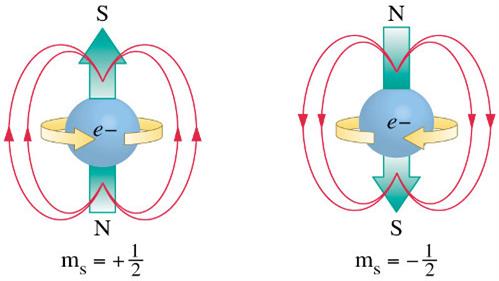
Քվանտային բջիջում էլեկտրոններից մեկը ներկայացնում են դեպի վեր ուղղված սլաքի ձևով, իսկ մյուսը՝ դեպի ներքև ուղղված սլաքի ձևով:

Աղբյուրները
Ա․ ԽԱՉԱՏՐՅԱՆ, Լ․ ՍԱՀԱԿՅԱՆ
Քիմիա-10, Երևան-2010